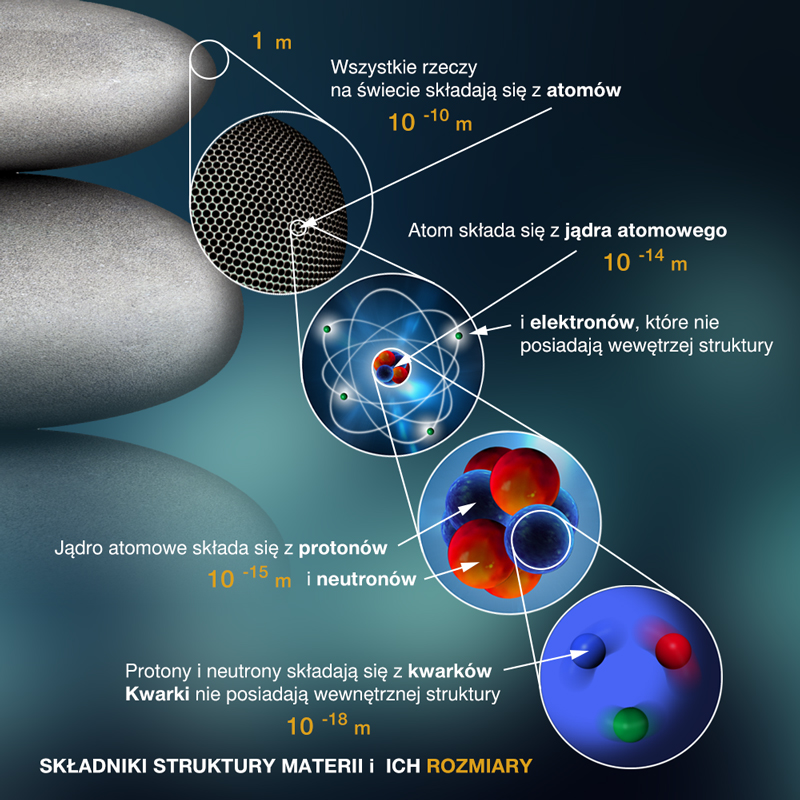
3.1. Miejsce jądra atomowego w strukturze materii
Świat jest piękny i ciekawy, zadziwia swą rozmaitością, a jednocześnie prostotą praw, które rządzą całą przyrodą. Wśród wszystkiego, co na świecie istnieje, człowiek wyróżnia się tym, że ma świadomość swego istnienia i stara się zrozumieć strukturę materii, której sam jest cząstką.
Jeśli więc podziwiasz górskie krajobrazy, zachwyca Cię tęcza, uśmiechasz się do bajecznie kolorowych kwiatów, to wiedz, że dostrzegasz tylko ostatni element piękna, którego pełnię odnajdziesz, wchodząc w świat struktury atomów i poznając prawa, jakimi kierują się elementarne składniki materii, aby tworzyć kolejne stopnie tej struktury prowadzące ostatecznie do tego, co podziwiasz swymi zmysłami.
Co na świecie jest najmniejsze?

Można też postawić pytanie inaczej. Czy istnieją takie najmniejsze cząstki, które już z niczego mniejszego się nie składają? Nazwiemy je cząstkami elementarnymi.
Starożytny filozof – Demokryt z Abdery uważał, że wszystko na świecie składa się z atomów, które są wieczne i niepodzielne (il. 3.3).

Poglądy Demokryta zyskały pełne uznanie dopiero w XIX wieku. Prace Johna Daltona oraz wielu innych wybitnych fizyków i chemików doprowadziły do sformułowania tzw. kinetyczno-molekularnej teorii materii, o której była już mowa w gimnazjum. Zakładając istnienie atomów, teoria ta wyjaśniała wiele zjawisk, w tym właściwości materii w różnych stanach skupienia, reakcje chemiczne, zjawiska cieplne, a także niektóre zjawiska elektryczne. Ogromnym sukcesem było utworzenie układu okresowego pierwiastków przez Mendelejewa, o czym wspomnimy w dalszej części tego rozdziału.
Jak to jednak w fizyce często bywa, wraz z ugruntowaniem się przekonania o tym, że materia składa się z atomów, pojawiło się pytanie: Czy atomy naprawdę są niepodzielne? Przecież wiemy o istnieniu ładunków elektrycznych, które są składnikami atomów!
Doświadczenie: Elektryzowanie
Elektryzowanie, to rozdzielanie ładunków elektrycznych. Wykonaj prosty eksperyment pokazany na fotografii (il. 3.4). Weź najprostszy długopis, potrzyj go chusteczką i zobacz, że przyciąga skrawki papieru. Przyciąga, bo rozdzieliłeś ładunki elektryczne w skrawku papieru, podobnie jak w pręcie pokazanym w doświadczeniu na filmie il. 3.5. Ładunki o znaku przeciwnym do tego, który jest na długopisie, gromadzą się na tej stronie papieru, która jest bliżej długopisu. Tak więc, długopis silniej przyciąga bliższy mu brzeg skrawka papieru, niż odpycha brzeg przeciwny – położony dalej. W efekcie skrawek papieru przylega do długopisu.

Ewolucja poglądów na strukturę materii w XIX i XX wieku
Skoro ładunki elektryczne – składniki atomów – można rozdzielać, to atom musi być podzielny! Wiemy, że ładunki elektryczne są dodatnie i ujemne. Ale jak one są rozmieszczone w atomie? Na początku XX wieku proponowano kilka modeli struktury atomu. Wszystkie one musiały uwzględniać znane w owym czasie właściwości atomów. Przypomnijmy je tutaj pokrótce.
- Rozmiary atomu szacowano na nieco ponad
. Ciekawostką jest, że rozmiary atomów różnych pierwiastków są do
siebie zbliżone.
 Ilustracja 3.6. Skala porównawcza rozmiarów atomuZiemia ma średnicę ok. , ziarnko maku ma średnicę ok. , zaś atom ma średnicę ok. . Gdyby ziarnko maku powiększać tak, że miałoby rozmiary kuli ziemskiej, to atom miałby rozmiary ziarnka maku
Ilustracja 3.6. Skala porównawcza rozmiarów atomuZiemia ma średnicę ok. , ziarnko maku ma średnicę ok. , zaś atom ma średnicę ok. . Gdyby ziarnko maku powiększać tak, że miałoby rozmiary kuli ziemskiej, to atom miałby rozmiary ziarnka maku - Masy atomów są różne: od ok. dla atomu wodoru do ponad dla atomów pierwiastków najcięższych.
- W skład każdego atomu wchodzą elektrony o masach znacznie mniejszych od masy atomu oraz o ładunku ujemnym.
- Atomy są elektrycznie obojętne. Znana była możliwość jonizowania atomu, czyli pozbawiania go (ewentualnie przyłączania do niego) jednego lub kilku elektronów.
Podstawowym problemem do rozstrzygnięcia była kwestia natury i rozłożenia ładunku dodatniego w atomie. Jedno z wyjaśnień podał Joseph J. Thomson, którego propozycję nazwano żartobliwie „modelem ciasta z rodzynkami” (il. 3.7).
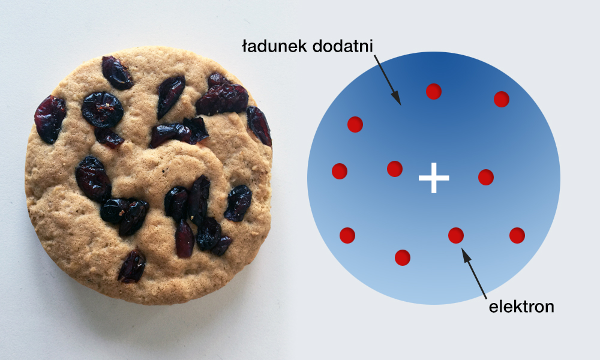
W modelu Thomsona ładunek dodatni stanowi praktycznie całą masę atomu i jest rozłożony w całej jego objętości. We wnętrzu tego ładunku, jak rodzynki w cieście, rozmieszczone są ujemnie naładowane elektrony. Był to model wyjaśniający niemal wszystkie znane ówcześnie właściwości atomów. Okazał się jednak niezgodny z wynikami późniejszych eksperymentów i dlatego musiał przejść do historii.

W pierwszych latach XX wieku angielski fizyk Ernest Rutherford chciał poznać bliżej strukturę atomu. Wraz ze swymi współpracownikami: Hansem Geigerem i Ernestem Marsdenem „bombardował” cienką folię ze złota (o grubości 0,0004 mm) cząstkami ze źródła zawierającego rad, odkryty przed kilkoma laty przez małżonków Curie. Badacze obserwowali błyski świetlne w detektorach ustawionych dookoła miejsca uderzania cząstek w folię (il. 3.9). Wiedziano już wówczas, że cząstki mają masę dużo większą niż masa elektronu, ale mniejszą od masy pojedynczego atomu złota.
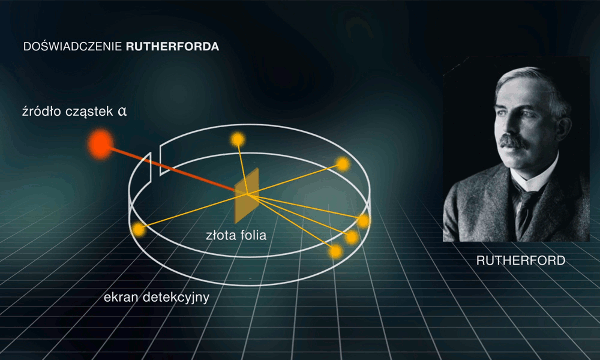
Cząstki padały na folię ze złota, która je rozpraszała – zmieniały one kierunek swojego ruchu wskutek zderzeń z atomami złota. Większość cząstek doznawała „rozproszeń do przodu” – kierunek ich lotu zmieniał się o bardzo niewielki kąt. Jednak Rutherford i jego współpracownicy zaobserwowali także „rozproszenia do tyłu” – przypadki, w których cząstki zmieniały kierunek swego lotu prawie o . Było to sprzeczne z modelem Thomsona, bowiem w tak luźnej strukturze jego atomu cząstki nie miały od czego się odbijać i rozproszeń do tyłu w ogóle być nie powinno. Chociaż rozproszenia wstecz zdarzały się ok. 20 000 razy rzadziej niż rozproszenia do przodu, to ich występowanie spowodowało konieczność odrzucenia modelu Thomsona.
Rutherford zaproponował więc model, w którym prawie cała masa atomu skupiona jest w bardzo małym obiekcie, znajdującym się w centrum atomu. Elektrony natomiast krążą na zewnątrz, na podobieństwo planet krążących wokół Słońca.

W celu sprawdzenia tego założenia Rutherford wykonał obliczenia, zakładając, że centralny obiekt działa na cząstki siłą odpychania elektrostatycznego. Pod wpływem tej siły tory cząstek odchylają się od pierwotnego kierunku (il. 3.11). Kąt odchylenia jest tym większy, im bliżej obiektu przelatuje cząstka. Nadlatująca na wprost cząstka zmienia całkowicie kierunek swego lotu i wraca – jest odbijana do tyłu. Wyniki obliczeń były zgodne z rezultatami pomiarów. Rutherford opublikował te informacje w 1911 roku.
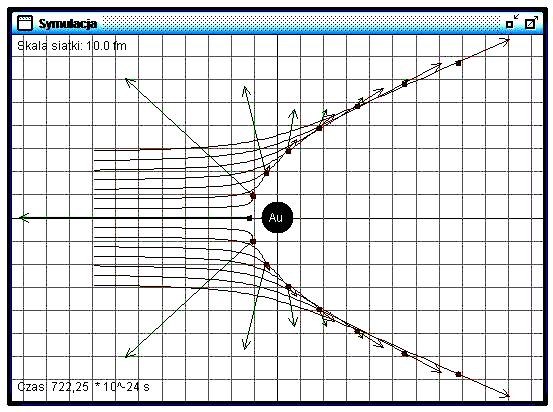
Dodatnio naładowany obiekt o bardzo małych rozmiarach, ale skupiający prawie cała masę atomu, nazwano jądrem atomowym. Jądro atomowe – element składowy atomu – znajduje się w jego centrum i skupia ponad 99,9% jego masy. Rozmiary jądra są ok. 10 000 razy mniejsze niż rozmiary atomu. Gęstość materii jądrowej jest ok. 1013 razy większa niż gęstość materii zbudowanej z atomów (1013 to dziesięć milionów milionów).
Zgodnie z tym modelem, atom staje się obojętny elektrycznie dlatego, że jądro otacza się tyloma elektronami, ile ma dodatnich ładunków elementarnych w swoim jądrze.

Składniki jąder atomowych
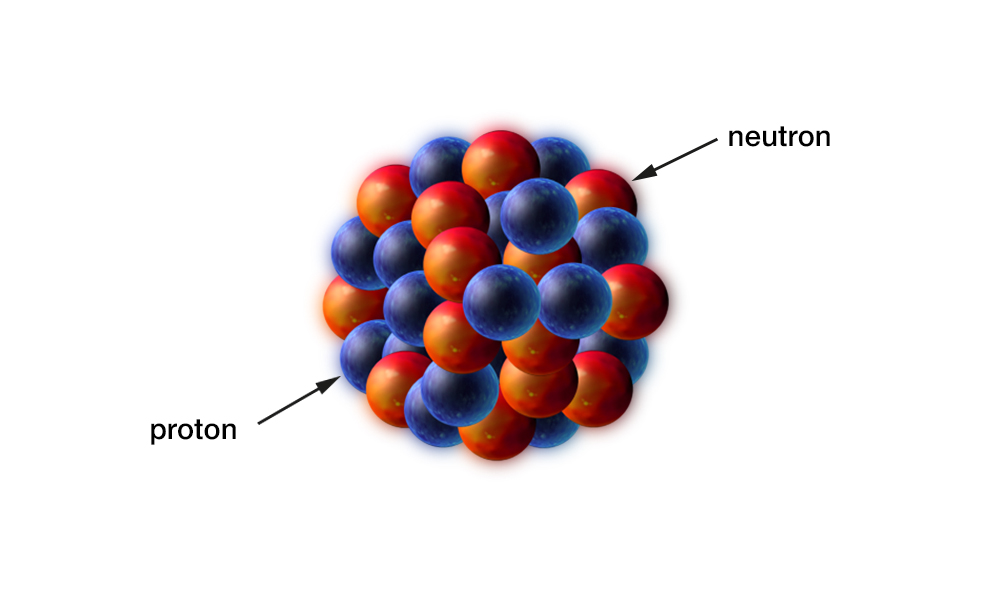
Po odkryciu przez Rutherforda jądra atomowego fizycy stanęli przed zadaniem rozstrzygnięcia, czy jest ono obiektem elementarnym, czy też ma jakąś strukturę. Od początku skłaniano się ku tej drugiej hipotezie. Przyjęto, że nośnikami dodatnich ładunków w jądrze są protony. Proton to cząstka elementarna o masie , 1836 razy większej od masy elektronu. W skład jądra, oprócz protonów, wchodzą też neutrony. Neutron (odkryty w 1934 roku) to cząstka obojętna elektrycznie o masie nieco większej od masy protonu.
Obydwie cząstki wchodzące w skład jądra – proton i neutron – mają wspólną nazwę: nukleon (il. 3.14).

Strukturę jądra atomowego opisują dwie liczby: i . – liczba atomowa, czyli liczba protonów w jądrze atomowym, – liczba masowa, czyli sumaryczna liczba protonów i neutronów w jądrze atomowym. Liczbę neutronów w jadrze oznaczamy zwykle przez . Miedzy tymi liczbami zachodzą następujące zależności:
Ładunek elektryczny jądra równa się sumie ładunków protonów:
gdzie – ładunek elektryczny jądra atomowego, – dodatni ładunek elementarny, czyli taki sam – co do wartości – jak ładunek elektronu, ale o przeciwnym znaku.
Na il. 3.16 przedstawiono schematycznie skład trzech jąder: jądra wodoru (pojedynczy proton), jądra deuteru (ciężki wodór – proton i neutron) i jądra helu (cząstki ), które składa się z dwóch protonów i dwóch neutronów.
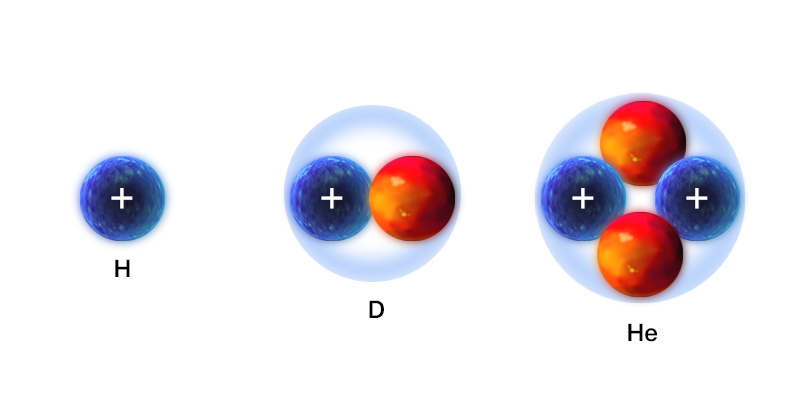
Struktura jądra atomowego a układ okresowy pierwiastków chemicznych
Wiemy z chemii, że układ okresowy pierwiastków (il. 3.18) porządkuje je według rosnącej liczby atomowej i grupuje w okresy oraz grupy – określające ich własności chemiczne. Okazuje się, że to uporządkowanie ma swoje podłoże w strukturze jąder atomowych.
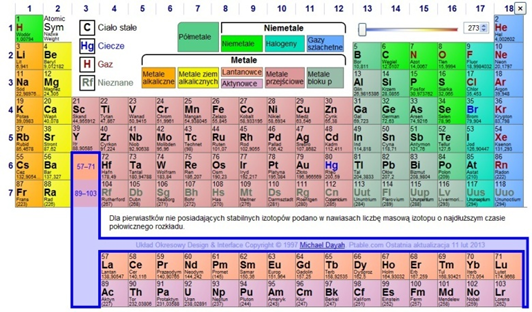
Dmitrij Mendelejew – twórca układu okresowego pierwiastków – uporządkował znane pierwiastki według ich własności chemicznych, rezygnując w kilku przypadkach z obowiązującej wcześniej zasady porządkowania zgodnie ze wzrastającym ciężarem atomowym. Obecnie mówimy, że układ okresowy pierwiastków porządkuje je według rosnącej liczby atomowej (ilości protonów w jądrze). Określenie ciężar atomowy, którego używał Mendelejew, jest określeniem historycznym. Dzięki zastosowanej przez siebie zasadzie uporządkowania pierwiastków uczony przewidział istnienie nieznanych w tamtych czasach pierwiastków, i to jeszcze zanim zostało odkryte jądro atomowe!

Przypomnijmy, że pierwiastek chemiczny to substancja, w której skład wchodzą atomy o tej samej liczbie protonów w jądrach atomowych, czyli o tej samej liczbie atomowej. Jest ona tożsama z numerem pierwiastka w układzie okresowym i określa jego własności chemiczne. Każdej liczbie atomowej przypisana jest inna, unikatowa nazwa pierwiastka. Zawartość jądra atomowego, w tym przede wszystkim liczba protonów w jądrze, jest więc podstawą klasyfikacji pierwiastków chemicznych.
Atomy tego samego pierwiastka mogą mieć różne masy. Wynika to z faktu, że jądra atomowe o jednakowej liczbie protonów mogą zawierać różną liczbę neutronów. Takie odmiany atomów noszą nazwę izotopów danego pierwiastka chemicznego. Większość pierwiastków ma kilka (niekiedy kilkanaście) izotopów, których atomy różnią się liczbą masową, oznaczaną symbolem . Własności chemiczne różnych izotopów tego samego pierwiastka są praktycznie jednakowe. Natomiast własności fizyczne jąder atomowych różnych izotopów są na ogół różne: np. jedne mogą być stabilne, inne zaś promieniotwórcze.
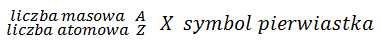
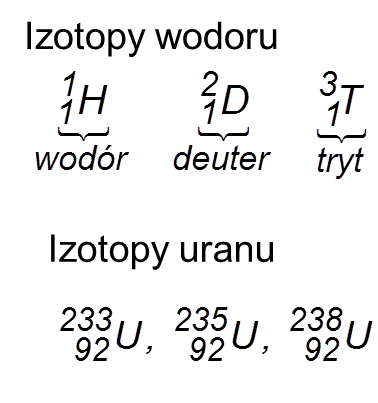
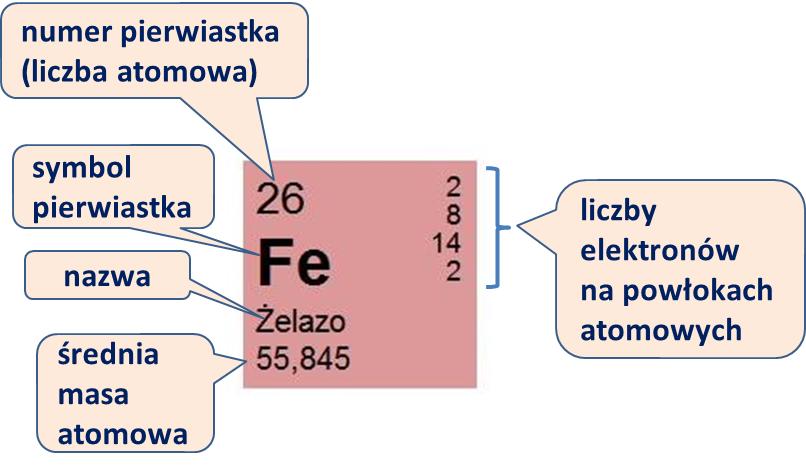
Na il. 3.22 podano typowe informacje o pierwiastku zawarte w układzie okresowym (na przykładzie żelaza):
- nazwę i symbol pierwiastka (dla żelaza: Fe, z łacińskiego ferrum);
- numer pierwiastka, czyli jego liczbę atomową , (dla żelaza ); oznacza to, że w jądrach atomów żelaza jest 26 protonów;
- średnią masę atomową (dla żelaza ); odzwierciedla ona sumaryczną liczbę protonów i neutronów w jądrach atomowych, uśrednioną po wszystkich izotopach pierwiastka, zgodnie z częstotliwością ich występowania w przyrodzie;
- liczbę elektronów na poszczególnych powłokach.
Obecnie znamy 118 pierwiastków chemicznych, z których 90 istnieje na Ziemi i w bezpośrednim jej otoczeniu. Pierwiastki o liczbach atomowych są niestabilne: wszystkie ich izotopy samorzutnie ulegają przemianom promieniotwórczym, o czym będzie mowa w rozdziale 3.3. Przemiany jądrowe. Pierwiastki o liczbie atomowej 43, 61 oraz większej od 92 zostały wytworzone przez człowieka w reakcjach jądrowych. Powstają one także podczas wybuchów masywnych gwiazd, w końcowych stadiach ich ewolucji. Dochodzi wtedy, zwykle na masową skalę, do różnych reakcji jądrowych, których skutkiem jest zamiana jednych pierwiastków w inne – efekt niemożliwy do uzyskania na drodze reakcji chemicznych.
Pytania i problemy
- Podaj nazwy cząstek wchodzących w skład atomów. Określ, czy są one naładowane dodatnio, naładowane ujemnie, czy obojętne elektrycznie.
- Podaj kilka przykładów zjawisk znanych z codziennego życia, w których daje się zauważyć elektryzowanie ciał lub skutki takiego naelektryzowania.
- Zapisz sześć rozbudowanych zdań porównujących model atomu Thomsona i model atomu
Rutherforda. Każde ze zdań musi odnosić się do jednego z zaproponowanych
poniżej zagadnień. Postaraj się, by zdania szczegółowo opisywały podobieństwa
lub różnice między modelami.
Przykładowe rozbudowane zdania:
Atomy przepuszczają padające na nie cząstki , nie wpływając praktycznie na kierunek ich ruchu.
Model Thomsona przewiduje, że cząstki alfa mogą być odchylane przez atomy, choć o bardzo niewielki kąt. Model Rutherforda dopuszcza odchylenia dochodzące nawet do od pierwotnego kierunku ruchu, choć zdarzają się one niezmiernie rzadko.
Przykładowe zagadnienia:
1. Atom jest elektrycznie obojętny.
2. Atom zawiera obiekty naładowane ujemnie.
3. Atom zawiera obiekty naładowane dodatnio.
4. Atom zawiera obiekty elektrycznie obojętne.
5. Materia w atomie jest równomiernie rozłożona w jego wnętrzu.
6. Obszar atomu w znaczącej części wypełnia próżnia.
- Podaj właściwość jąder atomowych, która decyduje o miejscu pierwiastka w układzie okresowym.
- Podaj właściwość jąder atomowych, która warunkuje występowanie izotopów.
- Znane są cztery stabilne izotopy żelaza: ; ; i . Podaj liczbę neutronów w jądrze atomu każdego z tych izotopów. Oceń, czy ten zestaw izotopów jest spójny ze średnią liczbę masową żelaza podaną w układzie okresowym pierwiastków.
- Oblicz stosunek liczby neutronów do liczby protonów w ciężkim jądrze atomowym, w którym stosunek .


 Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
