3.3. Przemiany jądrowe
Energie wiązania nukleonów w jądrach zależą nie tylko od liczby masowej, ale także od liczby protonów i neutronów. Spośród znanych izotopów stosunkowo nieliczne są takie kombinacje liczb i , przy których jądra atomowe są stabilne. Liczniejsze są kombinacje i , przy których jądra atomowe są niestabilne. Mówimy wówczas, że są to izotopy promieniotwórcze, które ulegają rozpadom. Niektóre kombinacje liczby protonów i neutronów w ogóle nie występują w przyrodzie.
Zjawisko promieniotwórczości naturalnej polega na samorzutnej przemianie jądra atomowego i związanej z tym emisji określonej cząstki. Nazwy przemian jądrowych pochodzą od nazwy emitowanej cząstki. Do naturalnych przemian jądrowych należą:
- Przemiana (alfa) – emisja cząstki , czyli jądra atomu helu .
- Przemiana (beta) – emisja cząstki , czyli elektronu lub pozytonu. Pozyton jest cząstką antymaterii o masie równej masie elektronu, ale o dodatnim ładunku elektrycznym.
- Przemiana (gamma) – emisja kwantu promieniowania elektromagnetycznego – fotonu.
Przemiana gamma towarzyszy zwykle przemianom alfa lub beta. Jądra tworzone w przemianach alfa i beta są na ogół w stanach silnie wzbudzonych. Przejście do stanów o niższej energii, a w końcu do stanu podstawowego odbywa się przez emisję jednego lub kilku fotonów.
Szczegółowy opis każdej z przemian przedstawiamy w kolejnych częściach tego rozdziału.
Przemiana (alfa)
Rozpad (lub przemiana) to samorzutny proces emisji z wnętrza jądra cząstki , która składa się z dwóch protonów i dwóch neutronów, czyli jest jądrem pierwiastka – helu .
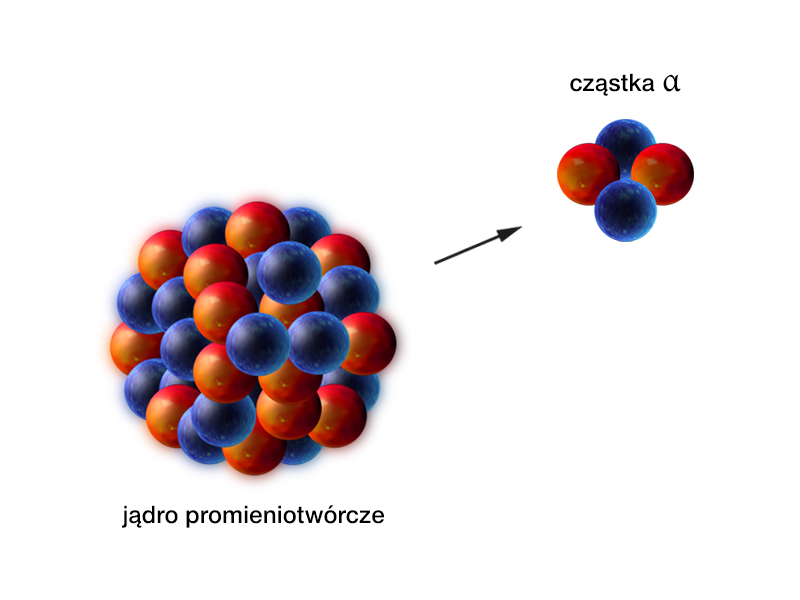
Zapis przemiany :
W przemianie liczba masowa jądra zmniejsza się o 4, , a liczba atomowa zmniejsza się o 2, . Wskutek tej przemiany część energii wiązania jądra zamienia się w energię kinetyczną cząstki . Energia wyzwolona wskutek różnicy mas jąder początkowego i końcowego (przypomnij sobie pojęcie defektu masy w rozdziale 3.2. Własności jąder atomowych) stanowi głównie energię kinetyczną cząstki .
Przykład przemiany , zapisany w postaci zbliżonej do równania reakcji chemicznej:
Dlaczego z jądra emitowana jest akurat czwórka nukleonów?
Okazuje się, że we wnętrzu jąder atomowych nukleony nie występują pojedynczo, lecz „chętnie” grupują się w podukłady – tym chętniej, im jądro jest bardziej masywne. Najprostszym takim podukładem jest właśnie cząstka . Jej powstanie jest energetycznie korzystne – świadczy o tym dość duża energia wiązania pojedynczego nukleonu w cząstce (około 7 MeV na nukleon), co zostało pokazane na „najważniejszym wykresie Wszechświata” (il. 3.27).
Można więc sobie wyobrazić, że w masywnym jądrze atomowym mamy do czynienia z wyodrębnionymi cząstkami ; każda z nich oddziałuje z pozostałymi nukleonami, z których jakaś część też jest pogrupowana w czwórki.
Przemiana zachodzi bez jakiejkolwiek ingerencji z zewnątrz. Podlegają jej przede wszystkim jądra atomowe o dużej liczbie masowej (czyli o dużej liczbie nukleonów), zdecydowanie przekraczającej .
Dlaczego czwórka nukleonów jest wypychana z wnętrza jądra?
Odpowiedzialne za to jest odpychające oddziaływanie elektrostatyczne między protonami w takiej wyodrębnionej czwórce a pozostałymi protonami w jądrze. To odpychanie jest kompensowane przez przyciągające siły jądrowe. Jednak im większa liczba masowa jądra (a za tym większa liczba protonów i neutronów), tym silniej odpychana jest owa wyodrębniona czwórka. Tymczasem przyciąganie siłami jądrowymi wcale nie musi stawać się silniejsze – ze względu na ograniczony zasięg sił jądrowych, o którym wspominaliśmy w poprzednim paragrafie (patrz rozdział 3.2. Własności jąder atomowych). Dlatego właśnie przemianie podlegają przede wszystkim masywne jądra pierwiastków z końca układu okresowego.
Z energetycznego punktu widzenia można to sobie wyobrazić tak, że w masywnym jądrze atomowym większość czwórek związana jest z jądrem „bezwzględnie”. Oznacza to, że ich wyrwanie z jądra (jest to proces analogiczny do wyrwania elektronu z atomu, czyli do jego jonizacji) wymaga dostarczenia odpowiedniej porcji energii (jest procesem endoenergetycznym). Natomiast niektóre czwórki związane są z jądrem stosunkowo słabiej – wyrwanie takiej czwórki jest procesem egzoenergetycznym, choć z punktu widzenia klasycznej mechaniki wymagałby on wstępnego dostarczenia porcji energii z zewnątrz dla jego inicjacji. Takie jądro jest -promieniotwórcze.
Przemiana (beta)
Rozróżniamy dwie wersje przemiany : przemianę oraz przemianę . W obu przypadkach przemiana polega na samorzutnej emisji, z wnętrza jądra, elektronu (przemiana ) lub pozytonu (przemiana ). Emitowanej cząstce towarzyszy jeszcze jedna cząstka, o której piszemy nieco dalej (O „cząstce-widmie” w przemianie , czyli co to są neutrina).
Przemianie podlegają te jądra atomowe, które mają nadmiar neutronów w stosunku do jąder stabilnych o tej samej liczbie masowej . Z kolei przemianie podlegają takie jądra, które mają nadmiar protonów w stosunku do jąder stabilnych o tej samej liczbie masowej .
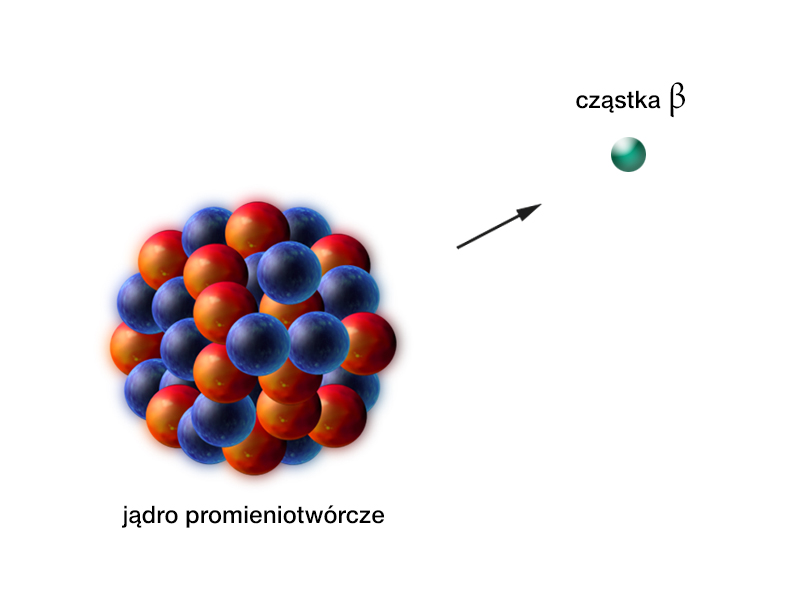
Zapis przemiany :
Zapis przemiany :
Symbolem oznaczony jest tu elektron, zaś symbolem pozyton. Wskutek tej przemiany część energii jądra zamienia się w energię kinetyczną wyemitowanych cząstek.
W przemianie liczba masowa jądra się nie zmienia, a liczba atomowa zmniejsza się lub zwiększa o 1:
- przemiana ,
- przemiana .
Przykład przemiany :
O „cząstce-widmie” w przemianie , czyli co to są neutrina
Gdy na początku XX wieku odkryto i badano promieniowanie , to sądzono, iż w wyniku tej przemiany emitowane są wyłącznie elektrony (cząstki ) bądź pozytony (cząstki ). Jednak już w latach dwudziestych stwierdzono, że cząstki emitowane przez określony izotop promieniotwórczy nie mają jednakowych energii kinetycznych! Ich energie zawierają się w określonym przedziale, tworząc ciągłe widmo energetyczne.
Odkrycie to było wielce zagadkowe, bowiem zarówno mechanika klasyczna, jak i powstająca wtedy mechanika kwantowa przewidywały, że emitowane w takich warunkach cząstki powinny mieć jednakową wartość energii kinetycznej. Przekonanie to było tak silne, że rozważano nawet hipotezę, iż przemiana podlega zasadzie zachowania energii „średnio rzecz biorąc”, a nie w każdym akcie przemiany. Takie podejście wymagałoby poważnego odstępstwa od zasady zachowania energii, będącej jednym z filarów fizyki.
W 1930 roku Wolfgang Pauli, austriacki fizyk pracujący w Zurichu, zaproponował przyjęcie tezy, że w przemianie emitowana jest nie jedna, lecz dwie cząstki: elektronowi towarzyszy emisja antyneutrina, zaś pozytonowi – emisja neutrina. W myśl tej „desperackiej” hipotezy (tak ją określił sam autor – chodziło przecież o ratowanie zasady zachowania energii!), reakcje przemian przebiegają następująco:
:
:
Symbolem oznaczono tu neutrino, zaś symbolem jego antycząstkę. Dostępna w reakcji energia dzieli się losowo między cząstkę i neutrino. Dlatego właśnie elektrony (pozytony) rejestrowane w przemianie nie mają zawsze jednakowych energii.
Zasadniczym problemem w związku z hipotezą Pauliego stanowiło to, że nigdy dotąd nie zarejestrowano, w żadnym doświadczeniu, obecności neutrina w przemianie . Mimo to hipoteza zyskała aprobatę fizyków, a odkrycie w 1956 roku (po upływie ponad ćwierci wieku!) reakcji wywołanej przez neutrina ostatecznie potwierdziło tę hipotezę.
Podstawową cechą neutrina jest nie tylko brak zdolności do oddziaływań silnych (tę zdolność mają jedynie kwarki), ale także brak zdolności do oddziaływań elektromagnetycznych (tę mają zarówno kwarki, jak i elektron). Neutrina mają zdolność jedynie do oddziaływań słabych – jest to czwarte oddziaływanie podstawowe w przyrodzie, obok grawitacyjnego, elektromagnetycznego i silnego. Proces wynikający z oddziaływania słabego jest znacznie mniej prawdopodobny niż ten, który wynika z oddziaływania silnego czy elektromagnetycznego – to zasadniczy powód, dla którego tak trudno jest doświadczalnie wykryć obecność neutrin.
Dzisiaj przyjmujemy, że neutrino jest pełnoprawną cząstką elementarną, na równi z elektronem i kwarkami. Wiemy także, że oprócz elektronu i „jego” neutrina w przyrodzie występują bardziej masywne, niestabilne odmiany elektronu, mion i taon, oraz stowarzyszone z nimi neutrina. Więcej na ten temat możesz przeczytać w Internecie – wprowadź w wyszukiwarkę nazwę lepton (jest to wspólne określenie elektronu, mionu, taonu oraz ich neutrin).
Przemiana (gamma)
W przemianie z wnętrza jądra atomowego emitowane są fotony, czyli kwanty promieniowania elektromagnetycznego. Przemiana jest na ogół następstwem przemiany lub . Jądro powstałe w wyniku tych przemian znajduje się najczęściej w stanie wzbudzonym (przypomnij sobie pojęcie stanu wzbudzonego atomu omówione w rozdz. 2.4. Budowa atomu). Oznacza to, że dysponuje ono swoistą „nadwyżką” energii, którą może wypromieniować na zewnątrz, właśnie w postaci kwantu promieniowania gamma, czyli fotonu.
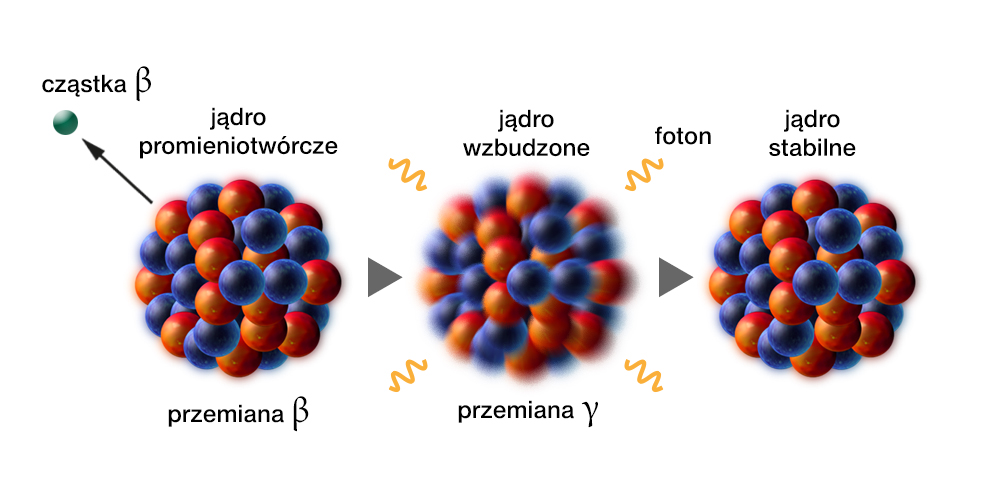
W przemianie nie zmieniają się liczba masowa jądra i liczba atomowa. Zmienia się natomiast stan wzbudzenia jądra. Zdarza się, że już po emisji jednego kwantu gamma jądro atomowe osiąga stan podstawowy i przestaje być -promieniotwórcze. Częściej jednak przejście z początkowego stanu wzbudzonego do stanu podstawowego, odbywa się etapami – jądro emituje kilka fotonów jeden po drugim, w bardzo krótkich odstępach czasu (rzędu nawet ), przechodząc po każdej emisji do stanu coraz mniej wzbudzonego. Uwzględniamy to w zapisie przemiany :
w którym symbol z gwiazdką, , oznacza jądro wzbudzone, zaś – liczbę fotonów wyemitowanych w trakcie przechodzenia do stanu podstawowego.
Przykład przemiany , której towarzyszy przemiana :
;
Energia fotonów emitowanych w trakcie przemian jądrowych jest znacznie większa (o kilka rzędów wielkości) od energii fotonów światła widzialnego, a nawet od energii nadfioletu. Te ostanie to wielkości rzędu kilku elektronowoltów, podczas gdy najmniejsza energia fotonów jest wielkością rzędu dziesiątek kiloelektronowoltów, a największa sięga nawet dziesięciu megaelektronowoltów.
Tak ogromna energia kwantów powoduje możliwość ich wykorzystywania w wielu sytuacjach, w których światło widzialne byłoby zupełnie nieprzydatne. Z drugiej jednak strony obcowanie z kwantami o tak wysokiej energii wymaga stosowania odpowiednich środków bezpieczeństwa. Zagadnienia te będą omawiane w rozdziale 3.9. Oddziaływanie promieniowania jądrowego z materią; jego detekcja i jego wpływ na organizmy żywe naszego kursu.
Tablica nuklidów. Ścieżka stabilności (podsumowanie i rozszerzenie wiadomości o przemianach promieniotwórczych)
W naukach przyrodniczych obowiązuje zasada systematyzowania i klasyfikowania poznawanych obiektów. Przypomnij sobie, dla przykładu, podstawowe informacje o trzech znanych układach klasyfikujących stosowanych w biologii, w chemii i w astronomii.
Gdy odkryto, że wchodzące w skład atomu jądro składa się z protonów i neutronów, to niemal oczywistym pomysłem na klasyfikację jąder atomowych było przyjęcie dwuwymiarowego diagramu. Na jego osiach odkłada się liczbę protonów oraz liczbę neutronów , składających się na jądro atomowe. Diagram ten nazywany jest tablicą nuklidów i zawiera informacje o wszystkich znanych jądrach atomowych, stabilnych, promieniotwórczych, zarówno występujących naturalnie na Ziemi, jak i wytworzonych sztucznie w laboratoriach.
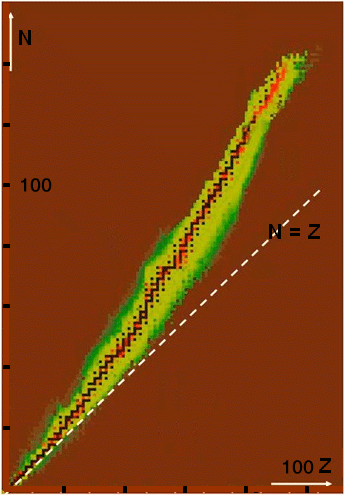
Z tablicy nuklidów można odczytać wiele ciekawych i istotnych informacji o jądrach atomowych.
Jak układają się stabilne jądra atomowe?
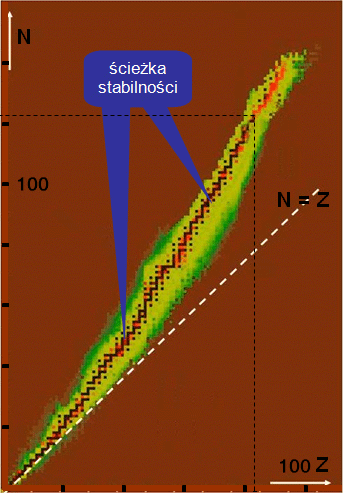
Stabilne jądra atomowe zaznaczono na tablicy nuklidów kolorem czarnym. Układają się one w dość wąskim obszarze. Pokrywa się on – dla jąder lekkich – z przerywaną linią . Jednak im bardziej masywne jądro, tym obszar stabilności bardziej odchodzi od tej linii, układając się nad nią. Dlaczego tak się dzieje?
W miarę zwiększania się liczby atomowej do zapewnienia stabilności jądra potrzebna jest nadwyżka neutronów w jądrze nad protonami. Wynika to z coraz silniejszego odpychania elektrostatycznego między coraz liczniejszymi protonami.
Najcięższe stabilne jądra atomowe, o , zawierają około 120 neutronów. Tak więc stosunek dla tych jąder jest zbliżony do 1,5. Przykładem jest tu jądro ołowiu . W jego okolicach kończy się znana nam ścieżka stabilności.
Gdzie znajdują się jądra -promieniotwórcze?
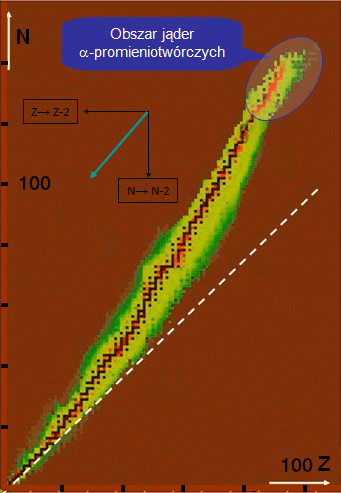
Większość jąder -promieniotwórczych zajmuje obszar na przedłużeniu ścieżki stabilności w prawo i w górę, choć należy pamiętać, że w tym obszarze znajdują się także jądra -promieniotwórcze. Przemianie podlegają jądra, w których liczba dodatnio naładowanych protonów jest tak duża, że ich odpychanie elektrostatyczne nie może zostać w pełni skompensowane obecnością neutronów i przyciąganiem sił jądrowych. W takiej sytuacji pozbycie się czwórki nukleonów, w tym dwóch protonów, jest energetycznie korzystne dla układu.
Wskutek przemiany jądro pozbywa się dwóch protonów oraz dwóch neutronów . W rezultacie jądro zbliża się do ścieżki stabilności (kierunek jego „przemieszczenia” zaznaczono w zwiększonej skali niebieską strzałką, obok ścieżki stabilności), niemal równolegle do niej. Kilkakrotna przemiana (towarzyszą temu na ogół przemiany ) doprowadza niestabilne początkowo jądro do ścieżki stabilności – staje się ono jądrem stabilnym.
Gdzie leżą jądra -promieniotwórcze?
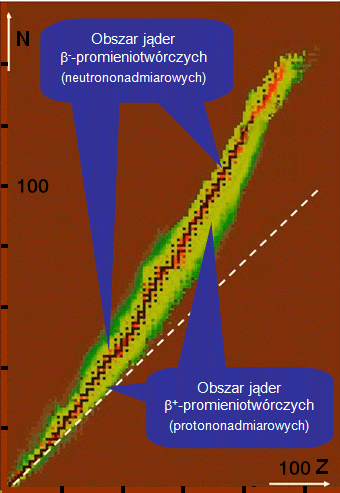
Jądra -promieniotwórcze odnajdziemy po obu stronach ścieżki stabilności, choć pamiętać należy, że w tym obszarze znajdują się także nieliczne jądra -promieniotwórcze. Ponad ścieżką stabilności i w lewo od niej mamy jądra podlegające przemianie , zaś pod ścieżką i w prawo od niej znajdują się jądra podlegające przemianie . Należy zwrócić uwagę, że określenia „neutrononadmiarowe” i „protononadmiarowe” nie dotyczą prostego porównania liczebności protonów i neutronów w jądrze. Nadmiar określa się tu w stosunku do ścieżki stabilności.
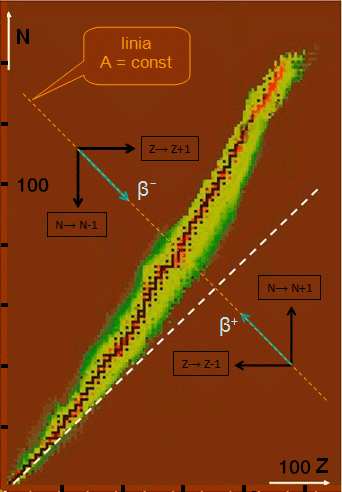
Wskutek przemiany jeden z neutronów wewnątrz jądra neutrononadmiarowego zamienia się w proton (towarzyszy temu emisja elektronu). W efekcie jądro przemieszcza się ku ścieżce stabilności po linii stałej liczby masowej , praktycznie prostopadłej do ścieżki stabilności (przemieszczenie to zaznaczono w powiększonej skali niebieską strzałką). Zamiana neutronu w proton jest w takim jądrze energetycznie korzystna, gdyż masa neutronu jest większa od masy protonu i taka przemiana najczęściej prowadzi do zwiększenia energii wiązania układu. Dlatego proces ten zachodzi spontanicznie.
Analogiczny opis można także przedstawić dla jąder protononadmiarowych.
Jakie znamy izotopy azotu? Które z nich są stabilne?
Spójrzmy na fragment tablicy nuklidów, powiększony wokół (taka jest właśnie liczba atomowa azotu). Z tego fragmentu możemy się wiele dowiedzieć.
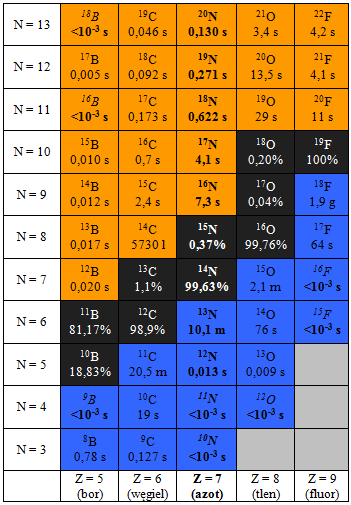
Azot ma dwa stabilne izotopy (pokazane na czarnym tle): oraz . Podano przy nich ich procentową zawartość w azocie występującym naturalnie na Ziemi. Możemy odczytać także analogiczne informacje dotyczące pozostałych pierwiastków, widocznych na naszym fragmencie tablicy nuklidów. Ich stabilne izotopy także pokazano na czarnym tle.
Azot ma cztery izotopy -promieniotwórcze, oznaczone kolorem niebieskim (tak jak izotopy pozostałych pierwiastków, podlegające przemianie ). Ma on także cztery izotopy -promieniotwórcze, oznaczone kolorem pomarańczowym. Przy izotopach niestabilnych podano tzw. czas połowicznego ich zaniku, o którym będziemy mówić w następnym rozdziale. Kursywą oznaczono te izotopy, których czas połowicznego zaniku jest krótszy niż 1/1000 sekundy, czyli takich, które – z „ludzkiego” punktu widzenia – rozpadają się natychmiast.
Cztery „wolne” miejsca oznaczają konfiguracje nukleonów nietworzące w ogóle stanu związanego. Przykładem takiej konfiguracji jest układ dziewięciu protonów i pięciu neutronów.
Na szczególną uwagę zasługuje izotop węgla – czas jego połowicznego zaniku wynosi ponad 5700 lat, czyli jest zaskakująco długi. Ta właściwość oraz to, że węgiel jest wszechobecnym składnikiem organizmów żywych, pozwala wykorzystywać ten izotop w... archeologii. Służy on do określania wieku szczątków organicznych znajdywanych w wykopaliskach. Więcej na ten temat opowiemy w następnym paragrafie.
Notatka historyczna: Jak odkryto promieniotwórczość?
Pewnego dnia w roku 1896 w Paryżu popsuła się pogoda. Po dniach słonecznych stało się pochmurno i francuski fizyk Henri Becquerel, który naświetlał na słońcu minerały, by potem obserwować ich świecenie w ciemności i rejestrować ten efekt na kliszy fotograficznej, musiał zrezygnować z naświetlania. Minerał, który miał być naświetlany, wraz z kliszą owiniętą w czarny papier schował do szuflady. Był to minerał zawierający związki uranu.
Gdy po kilku dniach wrócił do swej pracy, nie był pewien, czy klisza w szufladzie była naświetlona, więc na wszelki wypadek postanowił ją wywołać. To, co zobaczył, pokazuje fotografia obok. Zdziwił się, bo z powodu złej pogody kliszy nie naświetlał, a mimo to pojawiło się zaczernienie. Włożył znowu minerał z kliszą do szuflady, poczekał parę dni, wywołał i znów klisza była zaczerniona. Wtedy ogłosił, że minerały zawierające związki uranu wysyłają samoistnie nieznane dotychczas promieniowanie. Tak odkrył promieniotwórczość.
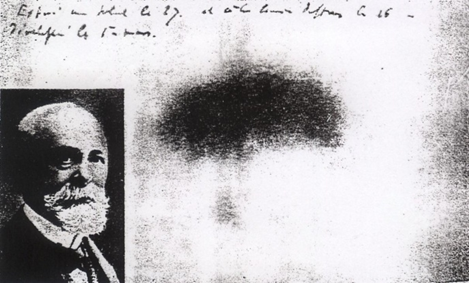
Badał potem własności tego promieniowania i doszedł do wniosku, że jest to promieniowanie podobne do promieniowania odkrytego nieco wcześniej przez Wilhelma Roentgena. Zmniejszyło to jego zapał i dalej niewiele się nim zajmował.
Tymczasem w Paryżu pojawiła się młoda studentka z Polski, Maria Skłodowska, która szybko ukończyła studia i poszukiwała tematu swej pracy doktorskiej. Po latach, w swojej książce (M. Skłodowska-Curie, Autobiografia i wspomnienia o Piotrze Curie, GAL, Warszawa, 2004) pisała o tym tak:
Zdecydowałam się wreszcie na temat swojej pracy doktorskiej. Uwagę moją zwróciły ciekawe wyniki badań Henri Becquerela nad solami rzadkiego metalu, uranu. Becquerel zauważył, że jeśli umieścić na płycie fotoicznej pokrytej czarnym papierem sól uranu, to zmienia się ona tak, jak gdyby padło na nią światło. Dzieje się to pod wpływem szczególnych promieni, wysyłanych przez sól uranową, różniących się od zwykłych promieni świetlnych, ponieważ mogą one przenikać przez czarny papier. Becquerel wykazał również, że te promienie potrafią rozbrajać elektroskop. Zrazu sądził on, że promienie uranowe powstają na skutek wyeksponowania soli uranowych na światło, lecz doświadczenie przekonało, że sole te, nawet po kilkumiesięcznym trzymaniu ich w ciemności, nie przestają wysyłać swych osobliwych promieni.
W tym czasie Maria poślubiła francuskiego fizyka Piotra Curie, który z zapałem włączył się do prowadzonych przez nią badań.

Przytoczony powyżej fragment pochodzi z autobiografii Marii Skłodowskiej-Curie; unikatowej opowieści pisanej ręką kobiety, która nie ma sobie równych w historii nauki. Zdecydowanie warto przeczytać całość. Tu przytaczamy jeszcze jeden fragment.

Miałam okazję zbadać sporą ilość minerałów; niewiele z nich okazało się czynnych, te mianowicie, w których znajdował się uran albo tor. Aktywność tych minerałów nie miałaby w sobie nic zadziwiającego, gdyby była proporcjonalna do ilości zawartego w nich uranu lub toru. Ale tak nie było. Niektóre z tych minerałów wykazywały aktywność trzy albo cztery razy większą, aniżeli wypadało z obliczeń dla uranu. Sprawdziłam ten uderzający fakt starannie i nie mogłam wątpić, że jest prawdziwy. Zastanawiając się nad jego przyczyną, doszłam do wniosku, że można go było wyjaśnić tylko w jeden sposób, a mianowicie, że musi istnieć w tych minerałach jakaś substancja nieznana, a bardzo czynna. Mąż mój zgodził się ze mną i nalegał, ażebyśmy od razu zaczęli poszukiwać tej substancji, w nadziei, że połączony nasz wysiłek szybko doprowadzi do jej wykrycia. Żadne z nas nie mogło jednak przewidzieć, że rozpoczynając tę pracę, wchodzimy na drogę nowej gałęzi wiedzy, którą podążać już będziemy do końca życia.
Ten tekst pokazuje, jak rodzą się odkrycia naukowe. Szczególną uwagę warto zwrócić na następujące fragmenty, pokazujące cztery spośród wielu aspektów takich narodzin:
1. Tworzenie nowych pojęć i nowego nazewnictwa: „...niewiele z nich okazało się czynnych” – owa „czynność” była nową, nieznaną wcześniej właściwością materii. Dziś powiedzielibyśmy „promieniotwórczych”, ale wtedy takie słowo nie istniało. To autorka wprowadziła słowo promieniotwórczość (angielskie radioactivity, francuskie radioactivité) do języka nauki.
2. Bazowanie na wynikach eksperymentu: „Niektóre z tych minerałów wykazywały aktywność trzy albo cztery razy większą, aniżeli wypadało z obliczeń dla uranu. Sprawdziłam ten uderzający fakt starannie i nie mogłam wątpić, że jest prawdziwy”. Niezgodność wyniku doświadczenia z oczekiwaniami pchnęła badaczkę do dociekania przyczyn takiego stanu rzeczy.
3. Stawianie hipotez i ich weryfikacja: „Zastanawiając się nad jego przyczyną, doszłam do wniosku, że ...musi istnieć w tych minerałach jakaś substancja nieznana, a bardzo czynna”. Rozpoczynając badania, Maria Skłodowska-Curie nie poszukiwała nieznanych pierwiastków, bo nie wiedziała o ich istnieniu. Dopiero wyznaczenie zawartości uranu i porównanie z własnościami promieniotwórczymi próbki pozwoliło na sformułowanie tej hipotezy; odkrycie polonu oraz radu stanowiło jej potwierdzenie.
4. Przewidywanie konsekwencji naukowych oraz pozanaukowych odkrycia: „Żadne z nas nie mogło jednak przewidzieć...”. Okazało się, że otwierają oni nie tylko nowe dziedziny wiedzy i robią to nie tylko dla samych siebie. Nauka o promieniotwórczości, o zjawiskach zachodzących na poziomie jąder atomowych weszła do dorobku całej ludzkości i dostarczyła ludziom narzędzi, które znalazły wszechstronne zastosowania w różnych dziedzinach; zastosowania te przyniosły różnorakie skutki, w większości bardzo korzystne, ale czasem też negatywne.
Pytania i problemy
- Rozpatrujemy jądra atomowe żelaza oraz astatu . Wskaż to z nich, które podlega przemianie , i zapisz równanie tej przemiany.
- Rozpatrujemy izotopy trzech pierwiastków: potasu , wapnia oraz skandu . Wiadomo, że jeden z nich jest stabilny, jeden jest -promieniotwórczy, a jeden jest -promieniotwórczy. Rozstrzygnij, którą z tych cech ma każdy z izotopów (wskazówka: zastanów się nad „nadmiarowością” protonów, neutronów). Zapisz równanie przemiany dla izotopów niestabilnych.
- Wskaż istotną różnicę między przemianą jądra atomowego a przemianami i .
- Przedstaw pojęcie ścieżki stabilności jąder atomowych.
- Opisz przemieszczenie jądra protononadmiarowego na tablicy nuklidów wskutek przemiany (skorzystaj z podobnego opisu dotyczącego przemiany ).


 Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
