2.3. Widma promieniowania gazów
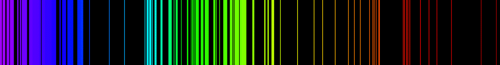
Światło emitowane przez rozrzedzone gazy składające się z pojedynczych atomów ma inny charakter niż promieniowanie termiczne ciał stałych. Widmo promieniowania gazów jest widmem liniowym. W przeciwieństwie do widma rozgrzanych ciał stałych, o których mówiliśmy w rozdziale 2.1. Promieniowanie termiczne, widmo gazów ma charakter nieciągły. Oznacza to, że emitowane jest światło o określonych długościach fal. Jeśli takie światło rozszczepimy, np. w pryzmacie, na ekranie zobaczymy pojedyncze linie. Przykładowe widma liniowe emitowane przez atomy azotu i żelaza pokazano na il. 2.16.
a)

b)
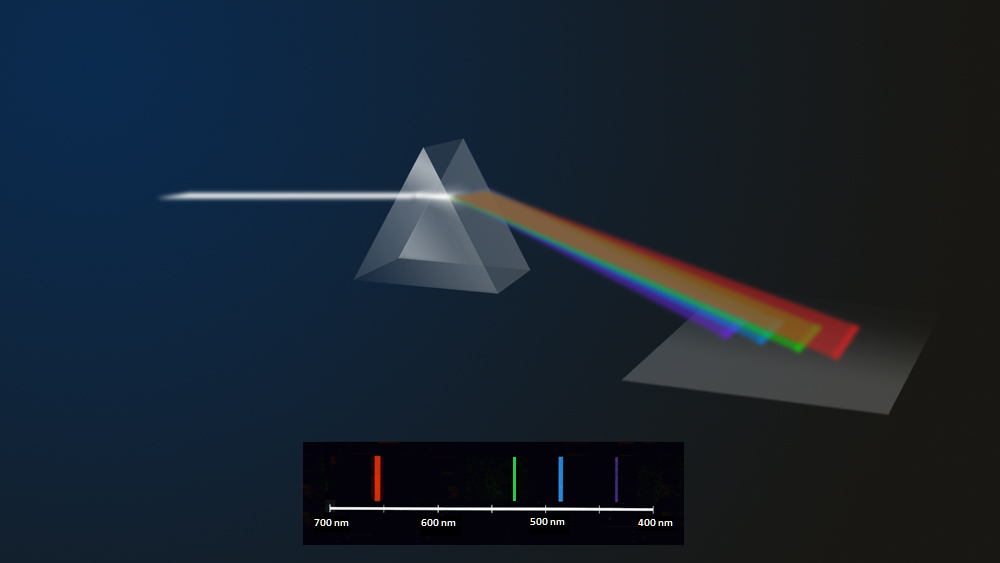
Na il. 2.18 przedstawiono schematycznie powstawanie widma gazu. Emitowane światło pada na pryzmat, który je rozszczepia, ujawniając jego fale składowe, widoczne na ekranie w postaci barwnych prążków, każdemu z których można przypisać określoną długość fali.
Johann Jakub Balmer w 1885 r. analizował widmo promieniowania wodoru. Zauważył, że w obszarze widzialnym widma częstotliwości fal wykazują ciekawą zależność. Wyraża się ją wzorem Balmera-Rydberga:
gdzie to dowolna liczba całkowita większa od 2 .
Długości tych fal możemy wyznaczyć ze wzoru:
Stała ma wartość:
Ze stałą związana jest stała , która nosi nazwę stałej Rydberga i jest przydatna przy wyznaczaniu długości fali; – prędkość światła), .
Linie widmowe odpowiadające długościom fal wyrażonym za pomocą wzorów (2.6) oraz (2.7) tworzą grupę albo serię linii zwanych serią Balmera.

Przykład: Seria Balmera
Seria Balmera znajduje się w części widzialnej widma. Oblicz długości fal odpowiadające tej serii oraz liczbę linii widmowych, które można zobaczyć. Przyjmij, że widmo widzialne obejmuje zakres długości fal .
Rozwiązanie: Wzór (2.6) daje możliwość obliczenia częstotliwości linii widmowych serii Balmera. Aby obliczyć odpowiednie długości fal, należy skorzystać ze wzoru . Prędkość światła .
Zatem długości fal wynoszą:
Stąd:
Ponieważ zakres widma światła widzialnego przypada dla , więc można zobaczyć tylko cztery linie widma wodoru (il. 2.19).
W późniejszych latach wykryto istnienie innych serii widmowych wodoru, leżących w nadfiolecie i podczerwieni. Częstotliwości fali we wszystkich seriach widmowych można przedstawić za pomocą jednego wspólnego wzoru:
gdzie i są liczbami naturalnymi. Liczba odpowiada kolejnemu numerowi serii. Dla serii o określonym liczba przyjmuje wartości:
Fizyka klasyczna nie potrafiła wyjaśnić charakteru widma liniowego. Stało się ono zrozumiałe po przyjęciu dwóch zasadniczych założeń:
- światło występuje pod postacią fotonów,
- energia atomu może przyjmować tylko określone wartości (które nazywamy energiami dozwolonymi atomu).
Podczas emisji światła atom skokowo obniża swoją energię, wysyłając kwant światła o energii:
gdzie jest stałą Placka, – częstotliwością, – długością fali światła, – prędkością światła w próżni.
Obniżenie energii atomu podczas emisji światła oznacza, że atom przechodzi ze stanu o wyższej energii do stanu o energii niższej . Obowiązuje zasada zachowania energii.
Energia stracona przez atom równa się energii wypromieniowanego fotonu:

Absorpcja światła przez gazy
Wiemy już, że świecenie gazów charakteryzuje się widmem liniowym, tzn. że atomy gazu wysyłają fale tylko o określonych długościach. Jeśli światło o ciągłym widmie przechodzi przez chłodny gaz, to w jego widmie na ciągłym kolorowym tle widoczne są ciemne linie. Są to linie widma absorpcyjnego.
Absorpcja to inaczej pochłanianie. Widmo absorpcyjne to widmo otrzymane w wyniku pochłaniania przez atomy padającego na nie światła.
Istnienie liniowych widm absorpcyjnych oznacza, że atomy gazu pochłaniają fale tylko o niektórych długościach. Ciemne linie widma absorpcyjnego znajdują się w miejscach, w których znajdują się linie widma emisyjnego danego gazu. Inaczej mówiąc: każdy atom pochłania takie światło, które sam jest w stanie emitować (il. 2.21).

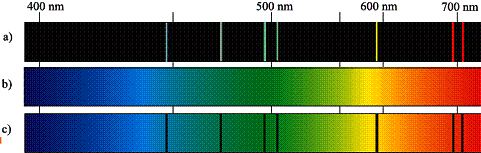
Gdy gaz oświetlimy światłem o widmie ciągłym, atomy gazu będą pochłaniać fotony o energiach charakterystycznych dla atomów gazów danego pierwiastka, którym odpowiadają charakterystyczne odległości między poziomami energetycznymi. Na rysunku il. 2.22c pokazano widmo absorpcyjne helu otrzymane, gdy światło o widmie ciągłym przepuszczono przez chłodny gazowy hel, a następnie rozszczepiono.
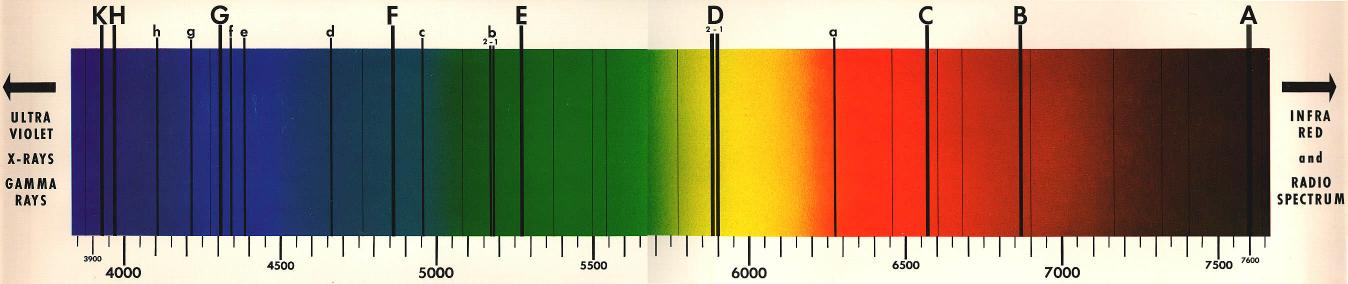
W widmie światła słonecznego występuje wiele linii absorpcyjnych. Są to tak zwane linie Fraunhofera (il. 2.23). Każda z nich wskazuje na obecność w atmosferze słonecznej (lub ziemskiej) jakiegoś pierwiastka. W ten sposób odkryto, że w atmosferze słonecznej występuje między innymi hel.
Widma liniowe odgrywają ważną rolę, ponieważ ich struktura jest związana z budową atomu. Dzięki temu możemy „zajrzeć” do wnętrza atomu. Wynika to z zasady zachowania energii. Jeżeli atom wypromieniuje kwant energii, to tyle energii musi stracić. Jeżeli zaabsorbuje światło, to taką ilość energii uzyska. Innymi słowy, badając energie światła emitowanego lub absorbowanego przez atom, możemy stwierdzić, jakie są różnice pomiędzy stanami energetycznymi atomu.
Pytania i problemy
- Wyjaśnij, dlaczego widma promieniowania gazów są liniowe.
- Zastanów się i powiedz, czym różni się widmo emisyjne od absorpcyjnego gazów. Wskaż ich cechy wspólne.


 Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
