7.D3. Dodatek: Chaos i porządek w przyrodzie (temat nadobowiązkowy)
Nieodwracalność procesów makroskopowych
Nieodwracalność procesów makroskopowych wydaje się czymś paradoksalnym. Przecież procesy te sprowadzają się do wielu mikroskopowych procesów mechanicznych – ruchów oddziałujących i zderzających się cząsteczek. Wiemy, że te ostatnie procesy są procesami odwracalnymi. Weźmy pod uwagę np. wzajemne zderzenie dwóch cząsteczek. Gdybyśmy nakręcili film z takiego procesu, a potem puścili taśmę w odwrotnym kierunku, wtedy zderzenie na filmie przebiegałoby tak samo, jak w rzeczywistości. Nie bylibyśmy w stanie zorientować się, w którą stronę porusza się taśma. Odwrócenie ruchu taśmy odpowiada odwróceniu biegu procesu w czasie. Odwracalność procesów mechanicznych wynika z praw Newtona, które mają tę własność, że jeżeli do równań z nich wynikających podstawimy , to otrzymujemy także prawidłowe rozwiązanie. Jednak, jeżeli przeprowadzimy podobny eksperyment z dużą liczbą cząsteczek, np. w swobodnie rozprężającym się gazie, to każdy zauważy, że „taśma filmowa została puszczona w przeciwnym kierunku”, gdyż samoczynne gromadzenie się gazu w jednej części naczynia (widoczne na filmie) w rzeczywistości nigdy nie występuje.
Co jest przyczyną nieodwracalności takich procesów? Skąd cząsteczki „wiedzą”, że powinny zajmować całą objętość naczynia i nie skupiać się w jednej tylko jego części? Dlaczego chaotyczne rozmieszczenie cząsteczek jest dużo bardziej prawdopodobne niż uporządkowane? Rozwiązanie tego zagadnienia znajdziemy w statystycznym charakterze praw rządzących układami składającymi się z dużej liczby cząsteczek.
W celu wyjaśnienia tego zagadnienia rozważmy prosty przykład rozmieszczenia w naczyniu dziesięciu niebieskich i dziesięciu czerwonych kuleczek w dwóch warstwach (il. 7.32). Załóżmy, że będziemy potrząsać naczyniem i za każdym razem zarejestrujemy rozmieszczenie kulek. Bardzo łatwo przekonamy się o tym, że kulki najczęściej będą rozmieszczone chaotycznie w obu warstwach (il. 7.32b), a rozmieszczenie uporządkowane (takie jak na il. 7.32a) wystąpi niesłychanie rzadko. Można eksperyment ten zasymulować w komputerze i kazać mu zliczać liczbę poszczególnych przypadków. Można też przeprowadzić obliczenia stosując kombinatorykę. Okazuje się, że liczba wszystkich możliwych rozmieszczeń jest bardzo duża – wynosi 184 756. W tabeli na il. 7.33 podano wszystkie przypadki rozmieszczeń kul w obu warstwach, z podziałem na poszczególne stany, gdzie stanem nazwaliśmy rozkład kulek charakteryzujący się określoną liczbą kulek niebieskich znajdujących się w górnej warstwie. Na przykład stan 10, charakteryzujący się tym, że w górnej warstwie znajduje się jedna kulka niebieska, może być utworzony na 100 sposobów (bo każdemu z dziesięciu położeń kulki niebieskiej w górnej warstwie odpowiada 10 możliwości rozmieszczenia kulki czerwonej w dolnej warstwie, stąd liczba możliwych ułożeń kulek w tym stanie: ).
Z tabeli można odczytać, że układ dziesięciu niebieskich i dziesięciu czerwonych kulek może się znajdować w 11 stanach. Każdemu z tych stanów odpowiada inna liczba możliwych kombinacji kulek, czyli inne prawdopodobieństwo termodynamiczne stanu.

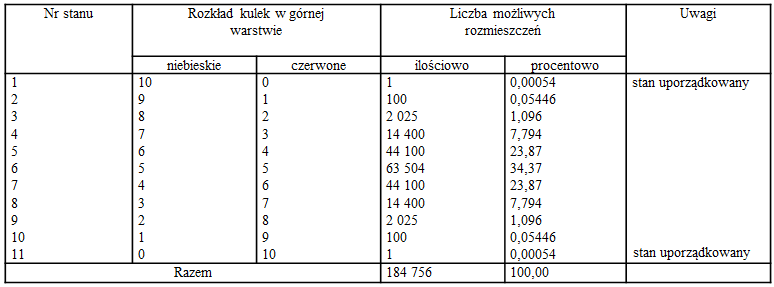
Z danych przedstawionych w tabeli na il. 7.33 wynika, że największe prawdopodobieństwo termodynamiczne występuje wtedy, gdy w górnej warstwie znajduje się połowa liczby kulek jednego koloru (stan nr 6) oraz w stanach bliskich temu stanowi (stany 5 i 7). Odpowiada to równomiernemu rozmieszczeniu kulek lub bliskiemu równomiernego ich rozmieszczenia. Najmniejsze prawdopodobieństwo termodynamiczne odpowiada całkowicie uporządkowanym stanom 1 i 11. Przełóżmy teraz powyższe wyniki na kategorię czasu. Prześledźmy nasze doświadczenie w czasie rzeczywistym. Załóżmy, że potrząsaliśmy naczyniem z częstością dwa razy na sekundę przez całą dobę. Wtedy okaże się, że układ będzie przebywać w stanie nr 6 aż około 8 godzin, w stanie nr 5 i 7 – po około 6 godzin, a w stanie całkowicie uporządkowanym 1 (i w stanie 11) – tylko około 0,5 sekundy! (Czyli zdarzy się to tylko raz w ciągu całej doby!) Oto przyczyna, z powodu której w skali makro występują procesy nieodwracalne, mimo że w skali mikro są całkowicie odwracalne. Zatem nieodwracalność procesu przemieszczania kulek w kierunku od stanu uporządkowanego do nieuporządkowanego wynika z prawdopodobieństwa termodynamicznego tych stanów. Ponieważ entropia rośnie wraz ze wzrostem prawdopodobieństwa termodynamicznego stanu, przejście od stanu uporządkowanego do nieuporządkowanego jest związane ze wzrostem entropii.
Doświadczenie to jest bardzo pouczające, gdyż wnioski z niego można uogólnić na dowolny układ składający się z dużej liczby jednakowych elementów, w którym zachodzą zdarzenia przypadkowe. Takim układem jest rozpatrywany przez nas przykład swobodnego rozprzestrzeniania się gazu. Możemy w myśli podzielić całą przestrzeń naczynia na obszary o małej objętości i obliczać liczbę sposobów, na które można rozmieścić cząsteczki gazu w tych obszarach. Oczywiście, liczba rozkładów cząsteczek gazu zgromadzonego tylko w jednej części naczynia (układ uporządkowany) jest dużo mniejsza od liczby rozkładów w całym naczyniu (układ nieuporządkowany).
Wszystkie procesy we Wszechświecie zachodzą zawsze w kierunku wzrostu entropii. Entropia jest miarą nieuporządkowania – miarą chaosu. Wszechświat zawsze zmierza od „porządku” do „chaosu”. Skoro tak, to skąd się wziął porządek we Wszechświecie? Dlaczego sytuacje, z którymi się spotykamy na co dzień, są w określonym stopniu uporządkowane i dlaczego w ogóle mogą zachodzić jakiekolwiek procesy? Skąd się wziął porządek?
Oto jedno z możliwych wyjaśnień. Przyglądając się naszemu eksperymentowi z potrząsaniem naczynia z kuleczkami, dochodzimy do wniosku, że jeżeli będziemy przeprowadzać ten eksperyment dostatecznie długo, to – chociaż jest to bardzo mało prawdopodobne – pojawi się przypadek całkowitego uporządkowania kulek. Potem, wraz z upływem czasu, kulki znów się wymieszają. Takie przypadkowe odstępstwo od stanu równowagi nazywamy fluktuacją. Zatem jedną z możliwych przyczyn wysokiego stopnia uporządkowania obecnego świata jest przypadek. Możliwe, że nasz Wszechświat doznał kiedyś w przeszłości fluktuacji, podczas której nastąpiło przypadkowe uporządkowanie wszystkiego, a obecnie wszystko zmierza ponownie do nieporządku.
Innym wyjaśnieniem dużego stopnia uporządkowania obecnego Wszechświata jest teoria Wielkiego Wybuchu, w której przyjmuje się, że na początku czasu wszystko było zgromadzone w bardzo małej przestrzeni. Stąd się wziął porządek i to jest praprzyczyną wszystkich procesów zachodzących w obecnym Wszechświecie!


 Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
Jeśli lubisz e-fizykę sprawdź nowe materiały projektu Stem4youth!
